23 - Difficultés de calcification
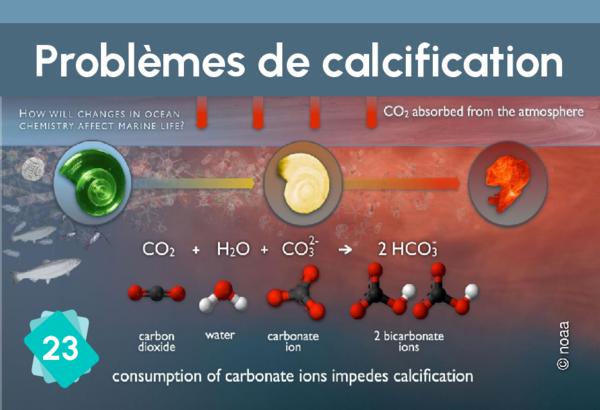

La formation du calcaire (calcification) suit la réaction chimique Ca++ + 2HCO3- ⇔ CaCO3 + H2O + CO2. Elle nécessite la présence d'ions bicarbonate (HCO3-). Or, la quantité de ces ions dans l'eau dépend du pH : dans l'eau, le dioxyde de carbone, l'acide carbonique, les ions bicarbonates et les ions carbonates sont en équilibre, en fonction du pH : CO2 + H2O ⇔ H2CO3 ⇔ H+ + HCO3- ⇔ 2 H+ + CO32-. L'ajout d'un acide déplace l'équilibre vers la gauche de l'équation. En d'autres termes, si le pH diminue, il y a moins d'ions bicarbonate, ce qui rend plus difficile la construction des coquilles par les organismes.
1Cause
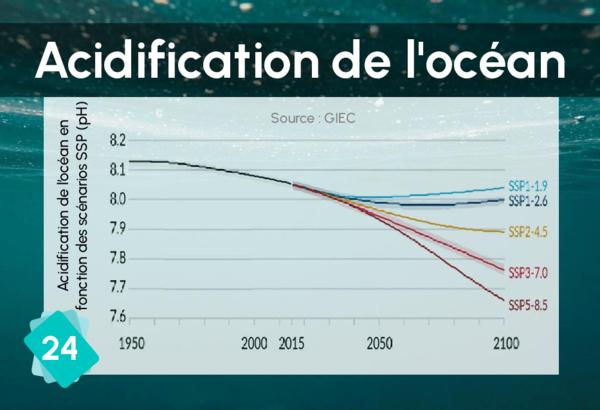
Si le pH baisse, la formation de
calcaire devient plus difficile,
notamment pour les coquilles.
SOURCES: IPBES 2.1.17.2 p190 // AR6 WG 3.2.3.1 p407 (p395) // https://www.annualreviews.org/doi/abs/10.1146/annurev.marine.010908.163834
1Conséquence
1Autre conséquence possible
Les problèmes de calcification ne concernent pas seulement les ptéropodes et les coccolithophores. Ils peuvent aussi impacter le corail par exemple. Donc ce lien est tout à fait acceptable.
SOURCES: AR6 WG2 3.4.2.1 p424 (p412) // https://www.annualreviews.org/doi/abs/10.1146/annurev.marine.010908.163834